Muskelfasertypen
Autor:
Billy Sperlich
Evidenzpyramide:
Muskelfasertypen & -spektrum
Muskelbioptische Verfahren erlaubten seit Mitte des letzten Jahrhunderts kleine Mengen an menschlichen Muskelproben (90 – 150 mg) histologisch („die Gewebe betreffend“) und bio-chemisch zu untersuchen [1]. Bioptische Verfahren gehören heutzutage zu gängigen invasiven Methoden in muskelpyhsiologischen Laboren.
Anhand diesen Untersuchungen konnten morphologisch („die Gestalt betreffend“) und metabolisch verschiedenen Muskel- und Muskelfaserarten [2] charakterisiert werden. Der Mensch besitzt mit
- der quergestreiften Skelettmuskulatur,
- der Herzmuskulatur und
- der glatten Muskulatur
drei verschieden Muskeltypen.
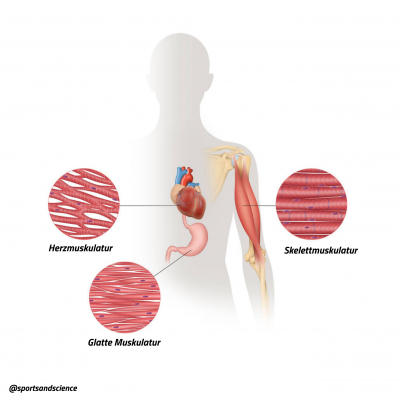
Muskelfasertypen beim Menschen
Muskelpastizität
Die Skelettmuskulatur ist willkürlich durch das zentrale Nervensystem steuerbar und ermöglicht über die Innervierung von α-Motoneuronen und motorischer Einheiten die Kontraktion der einzelnen kontraktilen Bausteine und damit mechanische Bewegungen. Insgesamt ist die Muskulatur je nach Trainingsreiz (z.B. Ausdauertraining, Krafttraining oder Inaktivität), Ernährung (z.B. Kohlenhydratrestriktion) und Umweltbedingung (z.B. Höhentraining) äußerst plastisch [3, 4] und kann sich je nach Trainingsreiz und -pause biopositiv oder -negativ anpassen. Allerdings zeigt die muskuläre Anpassung beim Menschen erhebliche inter-individuelle Variation, wahrscheinlich hauptsächlich bedingt durch genetischen Einfluss [5].
Die hohe Plastizität [6] der Skeletmuskulatur zeigt sich vor allem bei hochspezialisierten SportlerInnen in unterschiedlichen Sportarten z.B. im Langstreckenlauf oder Bodybuilding. Bodybuilder und Kraftsportler verfolgen mit ihrem Training das Ziel den Muskelquerschnitt durch Proteinaufbau (Hypertrophie) zu fördern [7]. Ausdauersportler hingegen versuchen vornehmlich die Sauerstoffverwertung durch Mitochondrienbiogenese (Aufbau von Mitochondrien) und Kapillarisierung zu steigern [8, 9].

Muskelfasertypen
Einer der wichtigen Mechanismen an unterschiedliche Reize ist die Fähigkeit der sogenannten „myosin heavy chain“ (MHC = Myosin-Schwerketten) mit unterschiedlichen Anpassungen zu reagieren. Im Wesentlichen definieren die MHC die unterschiedlichen Muskelfasertypen: Typ I, Typ IIa und Typ IIx. Strukturell unterscheiden sich die Muskelfasertypen durch ihre MHC sowie neuronale Ansteuerung.
Muskelfasern des Typ I besitzen im Vergleich zu Typ II-Fasern eine deutlich geringere Kontraktionsgeschwindigkeit, Kraftanstiegsrate sowie Entspannungsvermögen (Relaxation). Ursächlich hierfür ist vor allem die unterschiedliche Myosinkonfiguration und eine geringere Kalzium-ATPase-Aktivität.
Typ I-Fasern verfügen im Vergleich zu Typ II-Fasern über ein deutlich dichteres Kapillarbett und weisen dadurch eine höhere aerobe (oxidative) Kapazität auf. Typ I-Fasern werden entsprechend ihrer eher langsam verlaufenden Kontraktion langsam zuckende Fasern („slow-twitch“ oder ST-Fasern) bezeichnet.
Die Typ IIa- und IIx-Fasern besitzen eine hohe glykolytische (anaerobe) Kapazität [2, 10] aufgrund einer verstärkter Aktivität anaerober Schlüsselenzyme wie Laktatdehydrogenase (LDH), Phosphofruktokinase (PFK) oder Kreatinkinase (CK). Die Typ II-Fasern können schneller kontrahieren, ermüden dafür aber frühzeitig und werden daher als schnell-zuckend oder FT-Fasern („fast-twitch“) bezeichnet [2, 11]. Tabelle 1 zeigt die wesentlichen Muskelfasertypen, sowie deren grundlegen Charakteristika.
Tabelle 1. Muskelfasertypen sowie deren grundlegen Charakteristika, modifiziert nach [9]
| Fasertyp | I | IIa | IId(x) | IIb |
| Kontraktionstyp | Langsam | Schnell | Schnell | Sehr Schnell |
| Ermüdbarkeit | Niedrig | Mittel | Hoch | Sehr Hoch |
| Blutfluss | Hoch | Hoch | Niedrig | Niedrig |
| Energiereiche Phosphate | Wenig | Mittel | Viel | Viel |
| Glykolytische Aktivität | Niedrig | Mittel | Hoch | Hoch |
| Oxidative Kapazität | Hoch | Hoch | Mittel | Niedrig |
| Fettstoffwechsel | Hoch | Mittel | Niedrig | niedrig |
Je nach Muskelgruppe (z.B. Ober- oder Unterkörpermuskulatur) sind die Anteile der drei Muskelfasertypen unterschiedlich. Die Anteile an Muskelfasertypen sind vorrangig genetisch bestimmt. Durch spezifisches Training können tendenzielle Verschiebungen in beide Faserspektren stattfinden. Ob es wie früher angenommen zu einem kompletten Umbau bzw. zu einer „Umprogrammierung“ der Fasertypen kommen kann ist immer noch nicht eindeutig geklärt.
Einzelnachweise
- Bergstrom, J. and E. Hultman, Muscle glycogen synthesis after exercise: an enhancing factor localized to the muscle cells in man. Nature, 1966. 210(5033): http://www.ncbi.nlm.nih.gov/pubmed/5954569
- Saltin, B., et al., Fiber types and metabolic potentials of skeletal muscles in sedentary man and endurance runners. Ann N Y Acad Sci, 1977. 301: http://www.ncbi.nlm.nih.gov/pubmed/73362
- Hawley, J.A., et al., Nutritional modulation of training-induced skeletal muscle adaptations. J Appl Physiol (1985), 2011. 110(3): http://www.ncbi.nlm.nih.gov/pubmed/21030665
- Zierath, J.R. and J.A. Hawley, Skeletal muscle fiber type: influence on contractile and metabolic properties. PLoS Biol, 2004. 2(10): http://www.ncbi.nlm.nih.gov/pubmed/15486583
- Bouchard, C., T. Rankinen, and J.A. Timmons, Genomics and genetics in the biology of adaptation to exercise. Compr Physiol, 2011. 1(3): http://www.ncbi.nlm.nih.gov/pubmed/23733655
- Holloszy, J.O., Biochemical adaptations in muscle. Effects of exercise on mitochondrial oxygen uptake and respiratory enzyme activity in skeletal muscle. J Biol Chem, 1967. 242(9): http://www.ncbi.nlm.nih.gov/pubmed/4290225
- Phillips, S.M., A brief review of critical processes in exercise-induced muscular hypertrophy. Sports Med, 2014. 44 Suppl 1: http://www.ncbi.nlm.nih.gov/pubmed/24791918
- Pette, D. and R.S. Staron, Mammalian skeletal muscle fiber type transitions. Int Rev Cytol, 1997. 170: http://www.ncbi.nlm.nih.gov/pubmed/9002237
- Steinacker, J.M., et al., Skeletal muscle plasticity and training. Deutsche Zeitschrift für Sportmedizin, 2002. 53(12)
- Pette, D. and R.S. Staron, Myosin isoforms, muscle fiber types, and transitions. Microsc Res Tech, 2000. 50(6): http://www.ncbi.nlm.nih.gov/pubmed/10998639
- Bassel-Duby, R. and E.N. Olson, Signaling pathways in skeletal muscle remodeling. Annu Rev Biochem, 2006. 75: http://www.ncbi.nlm.nih.gov/pubmed/16756483

